SEDE E CONSUMO DA ÁGUA PELOS ANIMAIS DOMÉSTICOS
Referência: MORAES, I. A., NARDES, A.P.P.; MACHADO, A.C.M.B.C.; SOUZA JUNIOR, A. B. Sede e
consumo da água pelos animais domésticos. Webvideoquest de Fisiologia Veterinária.2018
INTRODUÇÃO
A água é considerada como vital, pois toda forma de vida na Terra é dependente da sua presença. Ela está diretamente relacionada com a sobrevivência dos organismos pois desempenha papel fundamental na manutenção da homeostase, entendida como sendo a capacidade de os organismos vivos manterem o ambiente interno dentro de limites toleráveis. A homeostase depende da adequada distribuição da água no organismo, além de outros fatores tais como a manutenção do pH e concentração de eletrólitos (LIMA & PIOCZCOVSKI, 2010).
A água é um elemento essencial para o funcionamento dos organismos vivos. Ela tem funções de solvente tornando muitos solutos viáveis para as diversas ações e reações metabólicas. Além disso, é um componente estrutural (fornece forma às células) e é essencial para todos os processos fisiológicos de digestão, absorção e excreção. Tem papel chave na estrutura e função do sistema circulatório e age como um meio de transporte para nutrientes e de todas as substâncias corpóreas. Ela mantém a constância física e química dos líquidos intra e extracelular e tem ainda uma função direta na manutenção da temperatura corpórea (MORAES e cols., 2016). Segundo a literatura, com uma perda de 20% de água pode ocorrer a morte do indivíduo, e uma perda de apenas 10% causará distúrbios severos.
Os animais conseguem água por três vias principais: através da ingestão voluntária de água em bebedouros e fontes naturais, através da dieta e como resultado de processos metabólicos, sendo 70-90% do volume necessário proveniente da ingestão voluntária. Por outro lado, os animais perdem água através da produção de leite, excreção urinária, excreção fecal, suor, evaporação e respiração (FARIA, 2010).
A PREENSÃO DA ÁGUA
As formas de preensão para ingestão da água variam entre os animais e estão na dependência da anatomia e fisiologia da boca, lábios e língua. A forma comum de preensão da água pela maioria dos animais domésticos é através da sucção criada pela inspiração associada com as contrações da língua (ARGENZIO, 2006). Os líquidos são sorvidos pelo acoplamento do lábio superior com o inferior, deixando uma estreita abertura. Já os felinos e caninos, diferentemente, transportam fluidos para a boca exclusivamente por meio da língua, cuja extremidade móvel forma uma concha voltada para a parte ventral (ANDRIGUETO e cols., 2006). Estes autores também informam que o porco introduz o focinho profundamente no líquido em função de sua boca prolongar-se muito para trás, e que os ovinos, por sua vez, ao ingerirem a água colocam apenas a porção média da fenda labial sobre o líquido, havendo retração da mandíbula e da língua, produzindo uma pressão negativa que aspira o líquido para o interior da cavidade oral.
A SEDE
A sede é a sensação associada à necessidade de ingestão de água do organismo que surge da necessidade orgânica em aumentar a quantidade deste elemento para a manutenção da fisiologia e garantir o equilíbrio hidroeletrolítico.
A perda de água no organismo é constante e normalmente é feita através do funcionamento renal (produção de urina), gastrointestinal (eliminação pelas fezes), respiratório (através do ar expirado pelos pulmões) e ainda a partir do suor evaporado da pele. O rim é o principal controlador da perda de água, pois é responsável pela filtração do plasma e tem condições de produzir urina de maior ou menor concentração de soluto ou água.
Como a perda de água pelo organismo é contínua, é preciso que haja a ingestão hídrica periódica para corrigir esse déficit. Isso porque os rins devem continuar a excretar a quantidade obrigatória de água até mesmo em uma pessoa desidratada para livrar o corpo do excesso de solutos ingeridos ou produzidos pelo metabolismo.
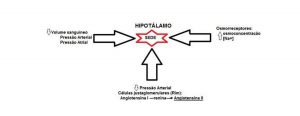
No controle do volume da água corporal os rins e o Sistema Nervoso Central, principalmente o hipotálamo, possuem papéis relevantes, e deverá existir uma perfeita integração entre eles para que o resultado final represente o equilíbrio dinâmico que é esperado (MORAES e cols., 2016).
Sendo assim, a percepção da sede pode surgir em resposta à desidratação (sede hipovolêmica) ou à sobrecarga de sódio (sede hiperosmótica) que levam à estimulação do centro da sede localizado no hipotálamo promovendo aumento da vontade de ingerir água. Isso porque como o hipotálamo apresenta barreira encefálica incompleta, seus neurônios conseguem detectar as condições do plasma e a presença de hormônios circulantes, através de osmorreceptores e receptores hormonais. Dessa maneira, receptores existentes no hipotálamo monitoram a osmolaridade do líquido cerebrospinal que o banha. Já a angiotensina II, por exemplo, é detectada por receptores nesta região do encéfalo que manda sinais para o centro da sede em outro local do hipotálamo – provavelmente o núcleo dorsomedial hipotalâmico. Com essa estimulação do centro da sede, aumenta-se a vontade de ingerir água (MOYES & SCHULTE, 2010).
A sede pode ser resultante também da resposta compensatória desencadeada pela ação dos barorreceptores relacionados com o controle da pressão arterial que são capazes de perceber a queda da pressão gerada pela carga cardiopulmonar e a queda do débito cardíaco. Além do aumento da sede outras respostas compensatórias, entre elas a ativação simpática, a diminuição do tônus vagal, a secreção aumentada de renina, aldosterona, ACTH, e vasopressina poderão estar presentes (FITZSIMONS, 1998).
Existe uma correlação direta entre o déficit de água e a necessidade de ingeri-la traduzida pela sensação da sede que só é aliviada após sua ingestão. O corpo é capaz de detectar depleções nos níveis de fluidos intra e extracelulares por meio de osmorreceptores e controlar o comportamento de ingestão de água a partir de sinais de hipovolemia intra e extracelular. Um déficit do volume plasmático de 8-10% já causa exacerbado apetite por água, um limite considerado alto quando comparado ao valor de 1-2% de desidratação celular que é necessário para levar à sede osmótica (FITZSIMONS, 1998; KUCHARCZYK & MOGENSON, 1976).
As partes do sistema nervoso central responsáveis por reconhecer, através dos osmorreceptores e receptores hormonais, as variações na composição sanguínea capazes de induzir a sede são: área lateral, pré-óptica e o núcleo supraóptico (SON) do hipotálamo, a área subfornical (SFO), e o mesencéfalo e bulbo do tronco encefálico (FITZSIMONS, 1998; KUCHARCZYK e cols., 1976; MOYES & SCHULTE, 2010; SAAD e cols., 2004a; SIMPSON & ROUTTENBERG, 1974).
PAPEL DO HIPOTÁLAMO
Dentro do hipotálamo, temos uma diferenciação entre o tipo de resposta à sede entre as áreas. A área lateral do hipotálamo (LH) incita o desejo de consumir água a partir de estímulos intracelulares de sede e a parte mais medial do hipotálamo está envolvida com os estímulos extracelulares de sede. Além de participar no estímulo da ingestão de água e sódio, a área lateral do hipotálamo também é importante na excreção de água e sódio e no controle da pressão arterial. A área lateral do hipotálamo, assim como diversas regiões no sistema nervoso central (SNC), depende da ação da angiotensina (AII) para exercer suas funções (KUCHARCZYK & MOGENSON, 1976; SAAD e cols., 2004b; TANAKA e cols., 2003).
A área pré-óptica é a região de controle osmorregulatório, que possui mecanismos envolvidos com a inibição hiposmótica (baixa osmolaridade) devida a ingestão excessiva de água.
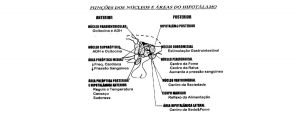
O hipotálamo também sintetiza, transporta e libera a vasopressina (hormônio anti-diurético, ADH) e a ocitocina. Esse órgão possui a capacidade de responder rapidamente a situações de desidratação (hiperosmolaridade sanguínea) e hiperhidratação (hipo-osmolaridade), ajustando a produção de ADH. Quando o ADH alcança o rim, aumenta a reabsorção de água nos túbulos contornados distais e coletores. Na ausência de ADH, maior diurese aquosa ocorre, tendo em vista a redução dessa reabsorção (KLEMM, 1996).
Diversos estímulos dipsogênicos, incluindo a angiotensina II, são capazes de estimular a liberação de vasopressina (ADH) a partir do sistema neurohipofisário (IOVINO & STEARDO, 1985).
A área subfornical do hipotálamo é uma estrutura circunventricular, pequena, considerada a região mais sensível, porém não a única, do SNC no sistema dipsogênico (BUGGY & FISHER, 1976; TANAKA e cols., 2003). Diferente do hipotálamo e do mesencéfalo, a área subfornical tem significativo destaque no que se refere à sua ação com a angiotensina II (AII) por ser uma área altamente vascularizada e desprovida da barreira hematoencefálica (BHE), que evita que moléculas polares, como a AII, a ultrapasse (FITZSIMONS, 1998). Nessa região encontramos receptores que permitem que a AII circulante interaja com as estruturas do SNC envolvidos na sede hipovolêmica, no apetite por sódio e no controle da pressão (FITZSIMONS, 1998; SAAD e cols., 2004a).
A área subfornical, além de ser influenciada pela ação da AII, também sofre influência do plexo sináptico colinérgico no que se refere ao controle de ingestão de água, ou seja, a área subfornical é sensível aos efeitos dipsogênicos tanto de AII, quanto de neuroquímicos colinérgicos centrais (SIMPSON & ROUTTENBERG, 1974).
TRONCO ENCEFÁLICO
No tronco encefálico, temos destaque para o núcleo do trato solitário, presente no bulbo. Este núcleo, assim como outras estruturas do tronco encefálico, faz parte de um sistema de feedback negativo para o controle do volume sanguíneo. Estes atuam mediante a resposta de barorreceptores e receptores de volume presentes na circulação e enviam projeções noradrenérgicas ascendentes e outras projeções para a região AV3V (FITZSIMONS, 1998).
SISTEMA LÍMBICO
Outra estrutura importante na ingestão de água é o núcleo septal, pertencente ao sistema límbico, que contêm diversos receptores para a angiotensina II e conexões neurais com os neurônios secretores de vasopressina (ADH) no hipotálamo. O núcleo septal impede a síndrome polidipsia-poliúrica por meio de sua ação nos níveis circulantes de vasopressina (ADH) perante a presença de hiperosmolaridade plasmática e hipovolemia extracelular, pertence, portanto, ao substrato neural do controle da sede e do balanço eletrolítico (IOVINO & STEARDO, 1985; SAAD e cols., 2004a).
Os sistemas de fibras nervosas angiotensinérgicas são amplamente distribuídas no sistema límbico e no tronco encefálico (FITZSIMONS, 1998).
CONTROLE E PERCEPÇÃO DA SEDE HIPOVOLÊMICA
A sede ocorre basicamente por dois motivos: hipovolemia e hiperosmolaridade plasmática. A sede hipovolêmica é iniciada por estímulos que causam um aumento na biossíntese periférica de angiotensina II (AII), que é um notável, potente e amplamente distribuído estímulo para o início desse comportamento de sede. Além de sua reconhecida influência na sede, a AII possui efeitos também na ingestão de sódio (BUGGY & FISHER, 1976; KUCHARCZYK e cols, 1976).
Sendo assim, a angiotensina II desempenha um papel importante na regulação da pressão sanguínea e na homeostase de fluidos e eletrólitos em mamíferos. Essa regulação é alcançada, em parte, por efeitos mediados por receptores e terminações angiotensinérgicas em órgãos periféricos como o córtex da adrenal, o músculo liso vascular e as terminações simpáticas. O papel dessas estruturas é responder ao aumento dos níveis séricos de AII que ocorrem durante a hipovolemia e a deficiência de sódio, e prover um estímulo adicional à sede quando o déficit é severo e de rápido desenvolvimento. Dentre as ações da AII encontramos: contração e hipertrofia do músculo liso vascular, ativação dos neurônios simpáticos, liberação de hormônios adrenomedulares, secreção de aldosterona, liberação de hormônios da hipófise, e conservação de sódio e água através dos seus efeitos na hemodinâmica renal e reabsorção tubular (FITZSIMONS, 1998; SAAD e cols., 2004b; SUMNERS e cols., 1991).
Em diversos outros órgãos, notavelmente o SNC, foi observado a presença de renina e outras enzimas que podem formar peptídeos de angiotensina independente do rim. A AII pode ser formada independentemente da enzima conversora de angiotensina (ECA), por outras vias que envolvem proteases do tipo serina calicreína e quimase. Essas proteases são capazes de ativar a pró-renina e metabolizar angiotensinogênio diretamente a AII. Concluímos, então, que a AII pode ser produzida dentro da barreira hemato encefálica, ou fora desta. Quando formada dentro, sua ação é ligeiramente mais importante no apetite de sódio do que de água. Devido essa característica, ela pode atuar como um neurotransmissor convencional ou como um hormônio parácrino.
Há destaque, também, para sua atuação no cérebro, especialmente na área subfornical, que contribui para a regulação da pressão sanguínea e do balanço fluidoeletrolítico. Essa regulação depende de efeitos mediados por receptores específicos para aumento de pressão, da ingestão de água e da secreção de vasopressina (FITZSIMONS, 1998; SUMNERS e cols., 1991; TANAKA e cols., 2003).
A AII é estável em suas aparições nas diferentes espécies, apenas duas variantes foram descritas, [Ile5] ANG II em humanos e diversos mamíferos e [Val5] ANG II em bovinos, ovelhas e vertebrados não-mamíferos. Esta é encontrada na grande maioria dos mamíferos e pássaros, diversos répteis e peixes vertebrados. Sua abrangente aparição na indução do comportamento da sede na filogenia reflete a importância evolucionária de se preservar a volemia e a pressão sanguínea. Animais que, em sua natureza, consomem água em baixa quantidade e frequência são menos responsivos às ações dipsogênicas da AII (EVERED & FITZSIMONS, 1981; FITZSIMONS, 1998).
As ações da AII são controladas por diversos fatores que podem alterar sua produção ou alterar a regulação de seus receptores. O sistema renina-angiotensina é conhecido por seu papel essencial na regulação periférica do balanço eletrolítico. A AII é o meio pelo qual os efeitos fisiológicos sistema renina-angiotensina são mediados (IOVINO & STEARDO, 1985; SAAD e cols., 2004b; SUMNERS e cols., 1991).
Os rins são considerados importantes órgãos de secreção interna do corpo. E uma das principais substâncias secretadas pelos rins é a renina. A renina renal é produzida pelas células do aparelho justaglomerular. A perfusão renal arterial reduzida aumenta a estimulação beta1-adrenérgica renal, as catecolaminas circulantes, as prostaglandinas e prostaciclinas, e todas estimulam a secreção de renina ativa, enquanto a AII, o peptídeo atrial natriurético (ANP) e vasopressina são inibitórios (FITZSIMONS, 1998).
O papel da renina aumentada durante a hipovolemia é reforçar as respostas hemodinâmicas, renais e dipsogênicas, especialmente quando o déficit é grande e de rápido desenvolvimento.
O aumento da atividade da renina plasmática é decorrente de alterações como a diminuição do volume (hipovolemia) ou pressão sanguínea e leva à manifestação do comportamento de sede. A renina circulante catalisa a conversão do peptídeo angiotensinogênio em angiotensina I, esse produto, por sua vez, é transformado na forma biologicamente ativa de angiotensina II pela ECA. A renina endógena produzida pelos rins é capaz de gerar AII suficiente para estimular a sede (BUGGY & FISHER, 1976).
A AII, proveniente de qualquer região, é apenas um dentre diversos fatores capazes de aumentar o apetite por água e sódio. Porém, seu destaque se justifica pela excepcional potência nessas ações (FITZSIMONS, 1998).
Mineralocorticóides e glicocorticóides influenciam na produção de AII e todas suas respostas mediadas por receptores. Por exemplo, a hipertensão induzida por mineralocorticóides envolve atividade aumentada do sistema renina-angiotensina, incluindo regulação positiva dos receptores de AII em locais específicos do hipotálamo e tronco encefálico. Os glicocorticóides são importantes reguladores dos locais de ligação da AII (SUMNERS e cols., 1991).
Diversos estudos já demonstraram a influência dos glicocorticóides na produção de AII por aumento na síntese do seu precursor angiotensinogênio e aumento da ECA. Como por exemplo o glicocorticóide Dexametasona, que aumenta a reatividade vascular à AII. A Dexametasona potencializa a resposta à AII e consequentemente a ingestão de água.
Sabe-se que existem grandes concentrações da ECA no hipotálamo, essa característica permite que a ação da angiotensina seja local e de rápida resposta e pode ser considerada uma alternativa à permeabilidade diminuída da angiotensina em regiões que possuem barreira hematoencefálica (KUCHARCZYK e cols., 1976).
OUTROS ESTÍMULOS DA SEDE
Em humanos o ressecamento da boca e das mucosas do esôfago podem causar a sensação de sede. Ainda que a água não tenha sido absorvida pelo trato gastrointestinal e não tenha exercido seu efeito sobre a osmolaridade do líquido extracelular. Estímulos gastrointestinais e faríngeos também influenciam a sede. Por exemplo, em animais experimentais, com fístula esofágica que impeça a ingestão de água e, portanto, a absorção pelo trato gastrointestinal, há alívio parcial da sede após a ingestão de líquido, embora esse alívio seja apenas temporário. Além disso a distensão gastrointestinal pode aliviar parcialmente a sede: nesse caso, a simples insuflação de um balão no estômago pode aliviar essa sensação. Contudo, o alívio das sensações de sede, por mecanismo gastrointestinais ou faríngeos, é de curta duração, pois a vontade de beber vem a ser completamente satisfeita apenas quando a osmolaridade plasmática e/ ou o volume sanguíneo retorna ao normal (HALL & GUYTON, 2017).
RESPOSTA INTEGRADA DOS MECANISMOS DO ADH E DA SEDE
Os mecanismos osmorreceptores-ADH e da sede atuam paralelamente, regulando com precisão, a osmolaridade do líquido extracelular e a concentração de sódio. Dessa forma, como descrito por HALL e GUYTON, 2017, quando um desses dois mecanismo falha, o outro restante, funcionando normalmente, ainda consegue controlar a osmolaridade do líquido extracelular e a concentração de sódio com eficácia razoável, contanto que haja ingestão suficiente de líquido para balancear as perdas de volume urinário obrigatório diário e as perdas hídricas ocasionadas por respiração, sudorese ou gastrointestinais. Entretanto, se ambos os mecanismos do ADH e sede falharem simultaneamente, a osmolaridade e a concentração plasmática de sódio passarão a ser controladas de forma precária. Na ausência desses mecanismos, não existe outro capaz de regular adequadamente a osmolaridade plasmática e a concentração plasmática.
CURIOSIDADES
1 – Origem do termo diabetes.
Polidipsia é um termo largamente usado na área da saúde e indica excessiva sensação de sede. Normalmente, quando há esse aumento da sensação e aumento da ingestão de água, aumenta também a produção de urina do animal. Esse aumento na produção e na micção é chamado de poliúria. Da associação das palavras polidipsia e poliúria, nasceu a palavra diabetes de origem grega, para referir à uma doença em que “toda a água ingerida não se retinha no corpo, mas era eliminada pelo rim”. De fato o doente diabético é um doente com desidratação crônica. A esta palavra se juntou “mellitus” (doce – açúcar na urina) ou “insipidus” (sem açúcar na urina, sem sabor) para definir as situações referidas.
2 – Os Camelos e sua ingestão de água.
Ao contrário do que muitas pessoas pensam a chamada “corcova” do camelo não é um reservatório de água e sim, de gordura que permite sustentá-lo nos períodos de privação da comida. Esses animais também conseguem se manter vivos diante da escassez de água. Como estratégias da evolução, esses animais são capazes de ingerir até incríveis 114 litros de água de uma única vez, para repor as reservas perdidas, ainda que sejam águas salobras. São capazes de nos meses de inverno ingerir somente a água das plantas. Além disso, para conservar esta água, assim como fazem os roedores do deserto, eles produzem uma urina extremamente concentrada e fezes bem ressecadas, eliminando pouca água. Além disso, para manter a temperatura corporal sem perda adicional de água pela sudorese, esses animais permitem a elevação da sua temperatura corporal de modo natural.
3 – Alimentos também ajudam na ingestão de água.
A partir da oxidação da matéria alimentar a água pode ser fornecida para o organismo. Cada grama de carboidrato fornece, aproximadamente, 0,6 mL de água. Já as gorduras, 1,1 mL de água/grama e as proteínas, 0,4 mL/grama. Entretanto, essa água só representa cerca de 5 a 10 % da necessidade de ingestão hídrica total, o que indica que a sede e a ingestão de água ainda é muito importante para o organismo funcionar normalmente.
4 – O teor de água em alimentos.
A vegetação verde contém entre 75% a 95% de água em sua matéria. Alfaces e pepinos alcançam o topo da lista, com aproximadamente 95% de água. Já frutas como a Laranja, apresentam em torno de 87% de água. As carnes têm um menor percentual, a de frango apresenta, quando assada, em torno de 7% de água e a bovina, 59%. Bolachas conhecidas como de água e sal, apesar do nome, apresentam apenas 3% de água. E por fim, os óleos, 0% de água.
REFERÊNCIAS BIBLIOGRÁFICAS:
-
ANDRIGUETO, J.M.; PERLY, L.; MINARDI, I.; GEMAEL, A.; FLEMMING, J.S.; SOUZA, G.A.; BONA-FILHO, A. Nutrição animal. As bases e os fundamentos da nutrição animal. Vol.1 – Os alimentos. Capítulo 3 – Digestão – processos gerais e particularidades por espécie animal. Editora Nobel. São Paulo. 2006.
-
ARGENZIO, R. A. Motilidade Gastrintestinal. In: SWENSON, M. J., REECE, W. O. Dukes Fisiologia dos Animais Domésticos. 12ª ed. Rio de Janeiro, RJ, Editora: Guanabara Koogan, Cap.24, p.362, 2006.
-
BUGGY, J.; FISHER, A. E. Anteroventral third ventricle site of action for angiotensin induced thirst. Pharmacology biochemistry and behavior, v.4. p. 651-660. 1976.
-
EVERED, M. D.; FITZSIMONS, J. T. Drinking and changes in blood pressure in response to precursors, fragments and analogues of angiotensin II in the pigeon Columba livia. Journal of physiology 310. p. 353-366. 1981.
-
FARIA, B. N. O volume de água ingerido pelas vacas está diretamente relacionado à produção de leite. 2010. Disponível em: <http://rehagro.com.br/plus/modulos/noticias/ler.php?cdnoticia=2006>. Acesso em: 12 set. 2016.
-
FITZSIMONS, J. T. Angiotensin, thirst and sodium appetite. Physiological reviews, v.78, n.3. p. 585-686. 1998.
-
HAUPT, T. R. Sede e ingestão de água. Capítulo 2. Água e eletrólitos. In: REECE, W. O. Dukes Fisiologia dos Animais Domésticos. 12ed. Rio de Janeiro. Guanabara Koogan. 2006.
-
IOVINO, M.; STEARDO, L. Thirst and vasopressin secretion following central administration of angiotensin II in rats with lesions of the septal area and subfornical organ. Neuroscience, v.15, n.1. p. 61-67. 1985.
-
KLEMM, W.R. Fisiologia Comportamental. In: DUKES/Fisiologia dos Animais Domésticos. 11ª Ed. p. 825-841. 1996.
-
KUCHARCZYK, J.; ASSAF, S. Y.; MOGENSON, G. J. Differential effects of brain lesions on thirst induced by the administration of angiotensin-II to the preoptic region, subfornical organo and anterior third ventricle. Brain research 108. p. 327-337. 1976.
-
KUCHARCZYK, J.; MOGENSON, G. J. Specific déficits in regulatory drinking following electrolytic lesions of the lateral hypothalamus. Experimental neurology 53. p. 371-385. 1976.
-
LIMA, G. J. M. M.; PIOCZCOVSKI, G. D. Água: principal alimento na produção animal. 2010. Disponível em: http://pt.engormix.com/MA-avicultura/administracao/artigos/agua-alimento-producao-animal-t300/124-p0.htm. Acesso em 12.08.2016.
-
MORAES, I. A.; AMIN, B. V.; CARVALHO, E. B. WebQuest de Fisiologia. Regulação dos fluidos corporais. Disponível em: <www.uff.br/WebQuest/pdf/osmo.htm>. Acesso em: 12 set. 2016.
-
MOYES, C. D.; SCHULTE, P. M. Fatores hipotalâmicos que regulam a sede. In: Princípios de Fisiologia Animal. Capítulo 10. Equilíbrio Hídrico e Iônico. 2ª ed. Artmed Editora, Porto Alegre. 2010.
-
SAAD, W. A., CAMARGO, L. A. A., GUARDA, I. F. M. S., SANTOS, T. A. F. B., GUARDA, R. S., SAAD, W. A., SIMÕES, S., RODRIGUES, J. A. Interaction between optic nucleus and septal ara in the control of water, sodium intake and arterial blood pressure induced by injections of angiotensin II. Pharmacology, biochemistry and behavior 77. p. 667-674. 2004a.
-
SAAD, W. A., GUARDA, I. F. M. S., CAMARGO, L. A. A., GARCIA, G., GUTIERREZ, L. I., SAAD, W. A., SIMÕES, S., GUARDA, R. S. Lateral hypothalamus lesions influences water and salt intake, and sodium and urine excretion, and arterial blood pressure induced by L-NAME and FK 409 injections into median preoptic nucleus in conscious rats. Life sciences 75. p. 685-697. 2004b.
-
SIMPSON, J. B., ROUTTENBERG, A. Subfornical organ: acetylcholine application elicits drinking. Brain research 79. p. 157-164.
-
SUMNERS, C.; GAULT, T. R.; FREGLY, M. J. Potentiation of angiotensin II-induced drinking by glucocorticoids is a specific glucocorticoid type II receptor (GR) -mediated event. Brain research 552. p. 283-290. 1991.
-
TANAKA, J.; MIYAKUBO, H.; FUJISAWA, S.; NOMURA, M. Reduced dipsogenic response induced by angiotensin II activation of subfornical organ projections to the median preoptic nucleus in estrogen-treated rats. Experimental neurology 179. p. 83-89. 2003.
-
HALL, John Edward; GUYTON, Arthur C. Guyton & Hall tratado de fisiologia médica. 13. ed. Rio de Janeiro: Elsevier, 2017.

